Culture media recipes
Sorry, this page is not available in english yet!
En microbiologie, un milieu de culture est un support gélosé qui permet la culture de cellules, de bactéries, de levures, de moisissures afin de permettre leur étude. Pour une description plus exhaustive des différents types de milieux de culture utilisés en laboratoire, vous pouvez consulter Wikipedia ![]() .
.
Vous trouverez ci-bas quelques recettes de milieux très utiles pour la croissance des microorganismes disponibles dans les différentes collections du CEF.
Si vous avez des questions, n'hésitez pas à contacter André Gagné.
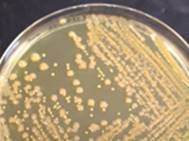
Gélose nutritive ensemencée
Pour consulter les différentes collections du CEF.
Pablum Cereal Agar (CER)
Pablum (Heinz) Céréales mélangées pour bébés…………………….25 g
Agar………………………………………………………………….........................5 g
H2O.....................................................Compléter jusqu'à 1 L
- Autoclaver 20 min. à 15 psi. Couler dans des boîtes de Petri tout en agitant le milieu entre chaque boîte.
Excellent milieu pour promouvoir la sporulation de plusieurs champignons incluant les moisissures foncées, les dermatophytes et autres hyphomycètes.
Référence : Padhye, A.A. et al. 1973. Ascocarp production by Nannizzia and Arthroderma on keratinous and non-keratinous media. Sabouraudia 11:109-114.

Flocons d'avoine
Oatmeal-salts Agar (OAT)
Magnesium sulphate………………………………………………....................1.0 g
Monopotassium phosphate…………………………………………...............1.5 g
Sodium nitrate……………………………………………………….....................1.0 g
*Flocons d’avoine (Gruau Quaker, caisson lente)…………………...10.0 g
Agar………………………………………………………………...........................18.0 g
H2O…………………………………………………………………….Compléter jusqu'à 1 L
* Passer le gruau au 'blender' jusqu’à l’obtention de morceaux très fins.
- Comme ce milieu bouille facilement, séparer dans deux fioles de 1 L.
- Ajuster le pH à 5.6.
- Autoclaver 15 min. à 15 psi. Couler dans les boîtes de Petri.
Aussi connu sous le nom de Weitzman-Silva Hutner Agar. Un milieu pour promouvoir le développement des stades méiotiques des Onygenales et autres ascomycètes.
Référence : Weitzman et Silva-Hutner. 1967. Non-keratinous agar media as substrates for the ascigerous state in certain members of Gymnoascaceae pathogenic for man and animals. Sabouraudia 5:335-340.

Neurospora crassa sur CMA
Cormeal Agar (CMA)
Cornmeal (yellow)……………………………………………………50 g
Agar………………………………………………………………….......15 g
H2O ……………………………………….…Compléter jusqu'à 1 L
- Autoclaver 15 min. à 15 psi. Couler dans les boîtes de Petri.
Milieu pauvre en nutriments utilisé pour promouvoir la sporulation, spécialement chez les ascomycètes et certains dermatiaceous hyphomycetes.
Référence : McGinnis, M. 1980. Laboratory handbook of medical mycology. Academic Press, Harcourt Brace Jovanovich, New York.
Potato Dextrose Agar (PDA)
Plusieurs recettes de PDA existent mais voici celle utilisée pour les collections.
Yeast extract………………………………………………………….2.5 g
Potato flour………………………………………………………….39.0 g
Glucose (dextrose)……………………………………………..10.0 g
Agar………………………………………………………………….....15.0 g
H2O…………………………………………...Compléter jusqu'à 1 L
- Autoclaver 15 min. à 15 psi. Couler dans les boîtes de Petri.
Milieu Volvox
Ce milieu sert à la croissance de quelques algues (e.g. Trebouxia sp.)
Solutions stock Ajouter à 1 litre d'eau

Trebouxia aggregata sur volvox
Ca(NO3)2 . 4H2O…………………(1.18 g/100 ml).................10 ml
MgSO4 . 7H2O……………………(0.40 g/100 ml)...................10 ml
Na2glycerophosphate . 5H2O………(0.50 g/100 ml)..........10 ml
KCl…………………………………(0.50 g/100 ml)..........................10 ml
Hepes……………………………….[1M].......................................10 ml
Biotine……………………………...(100 ug/100 ml).......................1 ml
B12…………………………………(100 ug/100 ml).........................1 ml
Thiamine…………………………...(1 mg/100 ml).........................1 ml
PIV metal solution………………...(*).....................................3 ml
- Ajuster le pH à 7.0 en ajoutant du NaOH [1N]
- Ajouter Agar 1,2 % pour milieu solide
(*)PIV metal solution
Ajouter à 500 ml d’H2O bidistillée
FeCl3 . 6H2O…………………. (0.097 g)
MnCl2 . 4 H2O………………… (0.041 g)
ZnCl2………………………….... (0.005 g)
CoCl2 . 6 H2O…………………..(0.002 g)
Na2MoO4……………………….(0.004 g)
Na2EDTA……………………….(0.750 g)
Modification du milieu Volvox (Provasoli & Pintner 1959).
Milieu LB (Luria Broth)
Ce milieu riche, liquide ou solide (avec agar), permet la multiplication des bactéries transformées (généralement Escherichia coli) lors de clonage moléculaire in vitro. Afin de rendre ce milieu sélectif au clones correctement transformés, on ajoute de l'ampicilline.
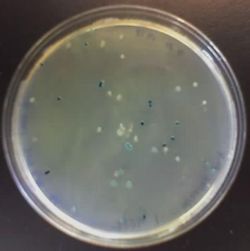
E.coli sur gélose LB
Bacto tryptone.........10 g
Bacto yeast extract....10 g
NaCl......................5 g
Agar (*)...............15 g (*) Pour milieu solide seulement
H2O..Compléter jusqu'à 1 L
- Ajuster le pH à 7,2 avec du NaOH [1N].
- Autoclaver 20 min. à 15 psi.
- Ajouter 1 ml d'ampicilline [100mg/ml] par litre de milieu après l'autoclave et lorsque la température du milieu aura atteint les 60oC et moins.
Référence : Sambrook, J., E. F. Fritsch, and T. Maniatis. (1989). Molecular cloning: a laboratory manual, 2nd edition. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.
Milieux BAP
Pour la culture des Frankia sp., selon les souches nous utilisons 2 milieux :
- Le milieu BAP-PCM
- Le milieu BAP
Solutions mères.......BAP-PCM (1L).........BAP (1L)
NH4Cl...........................5 ml...................5 ml
CaCl2*2H2O.................10 ml.................10 ml
Propionate de Na............5 ml.................15 ml
MgSO4*7 H2O................5 ml.................20 ml
Fe,NaEDTA[195mM].........1 ml..................1 ml
Oligoéléments.................1 ml..................1 ml
Vitamines BAP................1 ml...................----
Tampon BAP.................10 ml.................10 ml
Glucose.........................----...................2 g
Bacto peptone................----..................0,5 g
Extrait de levure..............----.................0,5 g
- Ajuster le pH à 6,7
- Autoclaver 20 min. à 15 psi.
- Le milieu BAP est utilisé tel que, par contre il faut ajouter extemporanément au milieu BAP-PCM du MES-TRIS (2 mL/100 mL) et de la phosphatidylcholine (26 uL/100 mL).
Vitamines BAP
Préparer les solutions suivantes :
Thiamine-HCl................11,21 mg/10 mL H2Od
Pyridoxine-HCl....................50mg/10mL H2Od
Acide folique......................10 mg/10mL H2Od
Pantothénate de Ca............10 mg/10mL H2Od
Acide nicotinique.................50mg/10mL H2Od
Biotine.......9mg/0,5 mL KOH 10N qsp 4 mL H2Od
Riboflavine........................10 mg/10mL H2Od
- Prendre 1 ml de chaques solutions pour 100 ml d’ H2Od, aliquoter par 1 ml en tube Eppendorf et stocker à -20oC. Les solutions mères de vitamines sont également conservées à -20oC.
Macroéléments
NH4Cl [1M]............................53,5 g/l
CaCl2*2H2O [13,5 mM]...............1 g/l
Propionate de Na [1M]............96,1 g/l
MgSO4*7 H2O [40,5 mM]..........10 g/l
Oligoéléments
H3BO3....................................2,86 g/l
MnCl2*4 H2O..........................1,81 g/l
ZnSO4*7 H2O.........................0,22 g/l
CuSO4*5 H2O.........................0,08 g/l
Na2O4Mo*2 H2O....................0,025 g/l
CoSO4*7 H2O........................0,001 g/l
Tampon BAP
Mélanger 560 ml d’une solution de KH2PO4 à 136,09 g/l [1M] et 320 mL d’une solution de K2HPO4 à 174,18 g/l [1M], ajuster le pH à 6,7 à l’aide d’une solution KOH [10N] et ensuite ajuster le volume à 1L.
MES-TRIS [0,5M] pH 6,8
Préparer une solution de MES (2(N-Morpholino) éthane Sulfonic acid) à [0,5M] et ajuster le pH à 6,8 avec du Tris (en poudre). Stériliser par filtration et utiliser 10 ml/l.
Phosphatidylcholine
Dissoudre 100 mg de phosphatidylcholine dans 24 ml d’éthanol à 96% et ajouter 6 ml d’H2Od . Stériliser par filtration et utiliser 260 ul/l.
Référence : Recette gracieuseté du Dr. Philippe Normand, Université de Lyon, France.